Negozio di doping di dottore
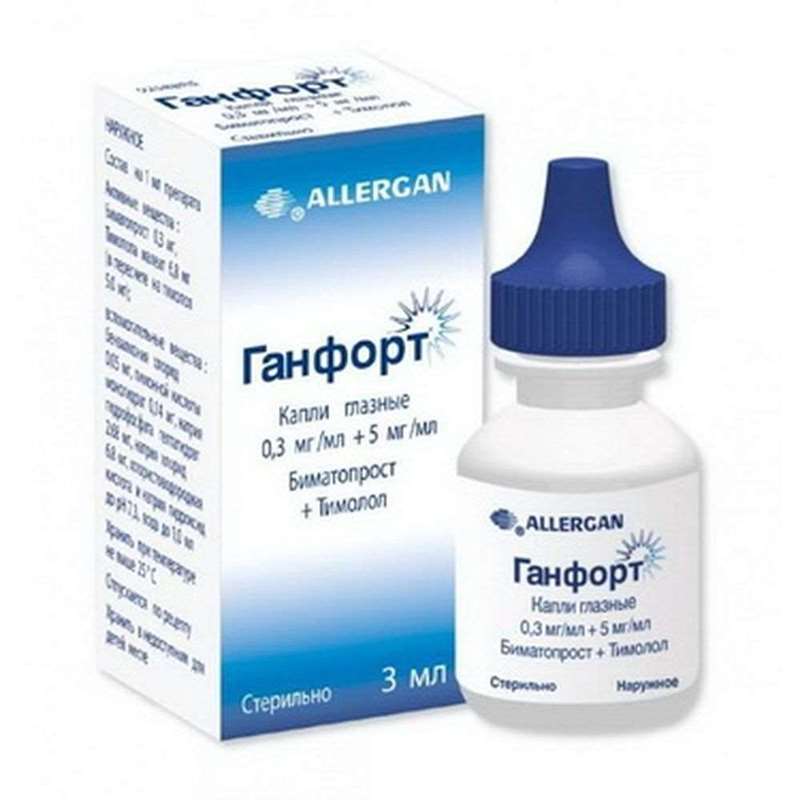
Ganfort gocce per occhio 0.3mg/ml + 5mg/ml, 3 millilitri
USD 48.99
Disponibile
Diventa il primo a recensire questo oggetto
Ganfort gocce per occhio - sono una preparazione oftalmica ad applicazione di attualità. Agente anti-glaucomatous unito, miotic, betabloccante.
Ganfort è un farmaco combinato, il suo bimatoprost costituente e timolol riducono la pressione intraoculare (IOP) a causa dell'interazione combinata, condurre a hypotensive molto più pronunciato intacca rispetto all'effetto di ciascuno dei componenti soli.
Bimatoprost
Si riferisce a proteam sintetici, la struttura chimica simile a prostaglandin F2α (PGF2α). Bimatoprost non ha effetto su nessuno dei tipi conosciuti di recettori prostaglandin. L'effetto hypotensive di bimatoprost è a causa di deflusso aumentato di liquido intraoculare attraverso il trabeculae e il sentiero uveoscleral dell'occhio.
Timolol
Il betabloccante nonselettivo, non ha sympathomimetic interno e attività stabilizzante la membrana.
Timolol riduce IOP riducendo la formazione di liquido intraoculare. Il meccanismo esatto di azione non è istituito, può esser associato con inibizione della sintesi di monofosfato di adenosina ciclico (il CAMPO) e è causato da stimolazione endogena di recettori adrenergici dalla beta.
Pharmacokinetics
L'assorbimento sistemico del farmaco è minimo, non differisce con trattamento combinato o con instillamento di ogni componente del farmaco separatamente.
In due studi su durata di 12 mesi, nessun cumulation sistemico di qualsiasi delle sostanze attive è stato annotato.
Bimatoprost
In vitro gli studi hanno mostrato che bimatoprost penetra l'iride e sclera. Quando il 0.03% instillating bimatoprosta la goccia della soluzione 1 in entrambi gli occhi una volta al giorno durante 2 settimane, la concentrazione massima (C max) di bimatoprost in plasma sanguigno è raggiunta tra 10 minuti dopo applicazione, e durante 1.5 ore la sua concentrazione nel plasma sanguigno è ridotta fino al limite più basso di scoperta (0.025 ng / il millilitro). C avaro max e l'area sotto la curva volte della concentrazione (AUC 0-24 h) di bimatoprost furono vicini durante giorni 7 e 14 e furono 0.08 ng / il millilitro e 0.09 ng * h / il millilitro, rispettivamente, indicando al fatto che la concentrazione di equilibrio di bimatoprost è raggiunta durante la prima settimana di uso.
Bimatoprost è moderatamente distribuito in tessuti, e il volume sistemico di distribuzione quando la concentrazione di equilibrio del farmaco è raggiunta è 0.67 l / il kg. Bimatoprost è principalmente nel plasma sanguigno. L'associazione di bimatoprost con proteine del plasma è l'approssimativamente 88%. Bimatoprost è sottoposto a ossidazione, N-deethylation e glucuronation con la formazione di vario metabolites.
Bimatoprost è excreted principalmente dai reni. Il circa 67% del farmaco, iniettato endovenosamente a volontari sani, è stato excreted nell'urina, e il 25% - attraverso il tratto gastrointestinale. La mezzovita (T 1/2) di bimatoprost, determinato dopo la sua amministrazione endovenosa, è stata approssimativamente 45 minuti; e l'autorizzazione di terra totale è-1.5 l / h / il kg.
Pharmacokinetics in casi clinici speciali
In pazienti anziani
Utilizzando bimatoprost 2 volte al giorno, il valore di AUC medio di 0-24 h in pazienti anziani è 0.0634 ng * h / il millilitro, che considerevolmente supera il valore di questo parametro nei giovani sani - 0.0218 ng * h / il millilitro.
Tuttavia, questa differenza non è d'importanza clinica, poiché l'esposizione sistemica di bimatoprost nella sua applicazione locale in pazienti anziani e i giovani sani rimane molto bassa. Cumulation di bimatoprost nella circolazione sistemica non è osservato, il profilo di sicurezza non è diverso in pazienti anziani e i giovani.
Timolol
In pazienti che si sono sottoposti a intervento di cateratta, dopo instillamento di gocce per occhio nella forma di una soluzione del 0.5%, C max timolol nel liquido intraoculare dopo che 1 h è stato 898 ng / il millilitro. Un po' del farmaco entra nella circolazione sistemica e è metabolized nel fegato. T 1/2 di timolol è circa 4-6 ore. Una parte di timolol, sottoposto a metabolismo nel fegato, è excreted attraverso il tratto gastrointestinale, e l'altra parte e metabolites sono excreted dai reni.
Timolol lega in una piccola dimensione con le proteine del plasma sanguigno.
Indizi:
Diminuzione in pressione intraoculare (IOP) in pazienti con glaucoma di angolo aperto e ipertensione intraoculare con efficacia insufficiente di applicazione di attualità di beta-adrenoblockers e cose analoghe prostaglandin.
Controindicazioni:
- Ipersensibilità ai componenti del farmaco.
- Sindrome di reattività aumentata delle vie respiratorie, compreso asma bronchiale negli stadi d'inasprimento ed episodi passati nell'anamnesi.
- Malattia polmonare che fa dell'ostruzionismo cronica (COPD) grave.
- Seno bradycardia.
- Blocco di Atrioventricular di II e III grado.
- Arresto cordiaco clinicamente espresso.
- Shock di Cardiogenic.
- Età a 18 anni.
- Gravidanza.
- Il periodo di allattamento al seno.
Accuratamente:
- La disfunzione del fegato e i reni (il farmaco non è sufficientemente studiato in questa categoria di pazienti).
- In pazienti con fattori di rischio per edema della macula (per esempio, con aphakia, pseudophakia, rottura di lente).
- In pazienti con diabete mellitus (il flusso instabile) e ha deteriorato la tolleranza di glucosio, perché la beta-adrenoblocker gumfort Timolol, che è la parte della preparazione, può mascherare segni d'ipoglicemia.
- In pazienti con cambiamenti incendiari negli occhi, neovascular, glaucoma infiammatorio, occlusivo, glaucoma congenito o glaucoma di angolo stretto (nessun dato su efficacia e sicurezza).
Istruzioni speciali:
Proprio come altri farmaci oftalmici, Ganfort può penetrare nella circolazione del sangue sistemica.
I sintomi di arresto cordiaco devono esser risarciti prima dell'uso di Ganfort della droga. È necessario regolarmente controllare la condizione di pazienti con arresto cordiaco severo, la definizione del tasso «.» cardiaco usando timolol, ci sono state relazioni di effetti collaterali dal sistema cardiovascolare e gli organi respiratori, compreso morti a causa di bronchospasm in pazienti con asma bronchiale, e anche meno spesso da arresto cordiaco.
La beta-adrenoblockers può mascherare sintomi d'ipoglicemia, hyperthyroidism e causare un peggioramento di angina pectoris di Prinzmetal, disordini vascolari periferici e centrali severi e hypotension.
In pazienti con manifestazioni atopic nell'anamnesi e reazioni anaphylactic severe a vari allergeni, le dosi di epinephrine (l'adrenalina), che sono di solito usati per arrestare reazioni anaphylactic, sullo sfondo dell'uso di betabloccanti possono essere inefficaci.
In pazienti con malattia di fegato epatica o attività inizialmente innalzata di enzimi-alanine di fegato l'aminotransferase (ALT), aspartate aminotransferase (la LEGGE) e / o il totale bilirubin, bimatoprost non ha intaccato la funzione di fegato durante il periodo di studio di più di 24 mesi.
Prima di trattamento di avviamento, i pazienti devono esser informati su crescita di ciglio possibile, pigmentazione della pelle di palpebra e pigmentazione d'iride, siccome questi effetti collaterali sono istituiti negli studi su bimatoprost e Gunfort. Alcuni cambiamenti possono essere permanenti, e possono esser accompagnati dall'apparizione di una differenza tra gli occhi, se gli instillamenti del farmaco sono stati effettuati solo in un occhio. Dopo che la preparazione di hashish è cancellata, la pigmentazione dell'iride può rimanere costante. Dopo di 12 mesi di trattamento con Gunforth, la frequenza di pigmentazione d'iride fu annotata nel 0.2% di pazienti. E dopo di 12 mesi di trattamento, solo bimatoprostom nella forma di occhio cala del 1.5%, più lontano aumenti della frequenza di questo effetto non fu osservato durante durata di terapia di 3 anni. L'aumento di pigmentazione dell'iride è a causa della produzione aumentata di melanocytes, e non semplicemente dall'aumento del loro numero.
Il supplemento di cloruro benzalkonium, che è la parte della preparazione di Ganfort, può causare l'irritazione della membrana mucosa degli occhi e i cambiamenti nel colore di lenti a contatto morbide. Le lenti a contatto devono esser tolte prima che il farmaco è amministrato, possono esser vestiti 15 minuti dopo instillamento.
Il cloruro di Benzalkonium può causare keratitis acuto e / o l'ulcera corneale tossica. A questo proposito, è necessario controllare la condizione del paziente con trattamento frequente o prolungato con Ganforth in individui con sindrome di occhio secca e con cambiamenti corneali.
Dopo aver aperto la fiala, è impossibile escludere la possibilità di contaminazione microbica dei suoi contenuti, che possono condurre a lesioni infiammatorie degli occhi. La durata di prodotto del farmaco dopo la prima apertura della bottiglia è 28 giorni. Dopo la scadenza del tempo specificato, la fiala deve esser scartata, anche se la soluzione non è completamente usata. È consigliato registrare sul pacco di cartone del farmaco la data di aprire la fiala.
L'effetto sulla capacità di manovrare veicoli e i meccanismi
Ci può essere un deterioramento visivo transitorio dopo l'amministrazione del farmaco, quindi il paziente deve aspettare finché la vista non è completamente restaurata prima di procedere a guida dell'auto o regolazione dei meccanismi.
Uso suggerito:
Dosi raccomandate in adulti (compreso pazienti anziani): 1 goccia è instillata nel sacco conjunctival dell'occhio intaccato 1 volta per giorno di mattina.
Se l'amministrazione del farmaco è mancata una volta, il farmaco è amministrato al giorno seguente. Non superi la dose di 1 iniezione una volta al giorno. Se più di 2 farmaci sono usati, è necessario prendere una pausa di 5 minuti tra ogni instillamento.
Imballaggio:
- Si trova in imballaggio originale. L'articolo è la marca nuova e chiusa.
Immagazzinamento:
- Si tenga lontano da luce del sole diretta.
- Tenga chiuso e lontano da bambini.
- Deposito in posto secco a temperatura di camera.
- Non superi la temperatura d'immagazzinamento più in alto che 25 C
L'avviso importante - il progetto di scatola esterno può differire prima di avviso precedente!
Prodotti imparentati


 Carro
Carro